Contrôle épigénétique de la transition épithéliale-mésenchymateuse dans les métastases cancéreuses
La transition épithéliale-mésenchymateuse (TEM) est au centre des métastases du cancer. Des modifications post-traductionnelles anormales des histones affectent l'expression de gènes marqueurs clés de la TEM, renforçant ainsi ce processus. Cet article présente brièvement les métastases et la TEM et décrit le rôle de l'épigénétique dans la progression du cancer.
Métastases du cancer
Les métastases sont le processus par lequel les cellules cancéreuses d'un site primaire se propagent à des sites secondaires. Les cancers métastasés ont un pronostic nettement plus défavorable que les cancers non métastasés. Par conséquent, une grande partie de la recherche en oncologie se concentre sur la compréhension de la biologie des métastases et de leurs causes sous-jacentes.
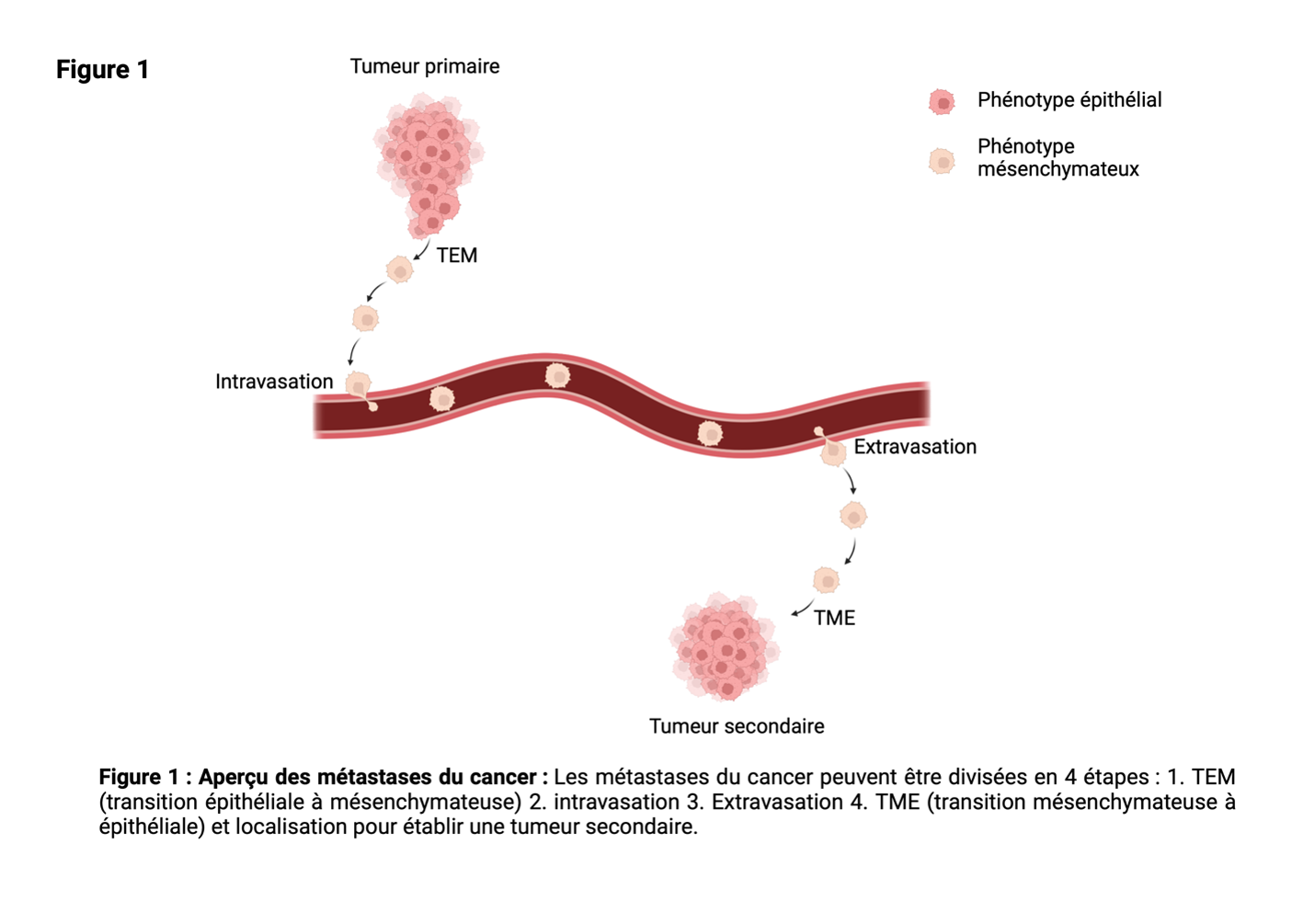
La métastase peut être divisée en plusieurs étapes :
1. On trouve sur le site de la tumeur primaire un groupe de cellules anormales qui n'ont pas encore envahi les tissus environnants. Cette condition est appelée carcinome in situ.
2. Certaines cellules cancéreuses de la tumeur primaire acquièrent un phénotype invasif et migratoire. L'un des processus les plus importants pour l'acquisition de ce phénotype est le processus biologique cellulaire appelé transition épithéliale-mésenchymateuse (TEM).
3. . Les cellules cancéreuses migratrices entrent dans la circulation par les vaisseaux sanguins ou lymphatiques.
4. Les cellules cancéreuses migratrices quittent les vaisseaux sanguins/lymphatiques par extravasation à travers les parois vasculaires dans un tissu distant ou un site secondaire.
5. Sur le site secondaire, les cellules cancéreuses retrouvent leur phénotype non migratoire d'origine par une transition mésenchymateuse-épithéliale (TME) et établissent des colonies microscopiques.
6. Les colonies microscopiques prolifèrent pour former des lésions métastatiques cliniquement détectables.
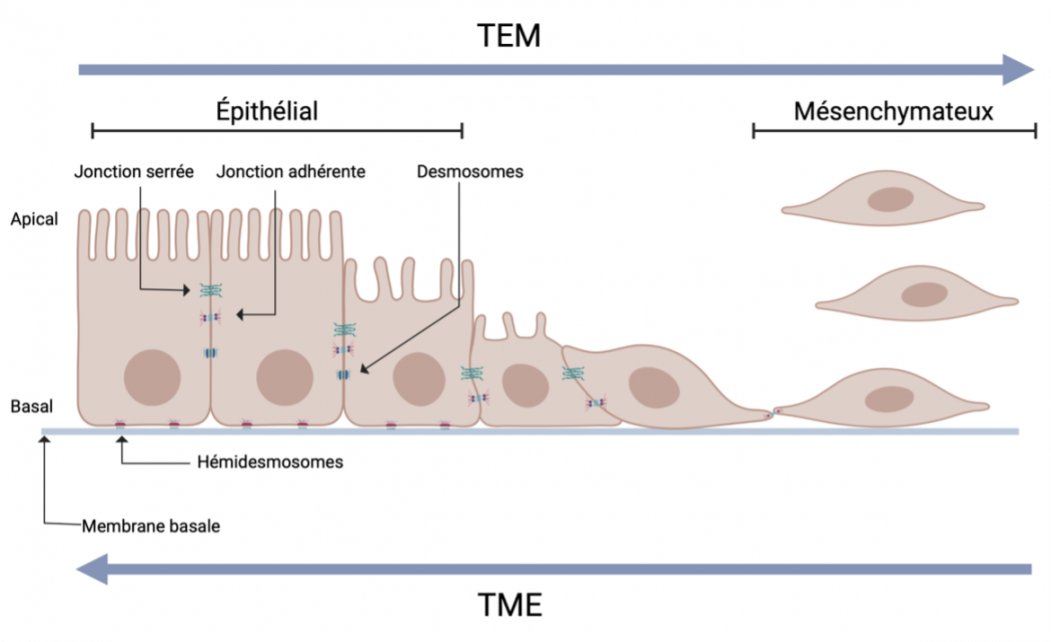
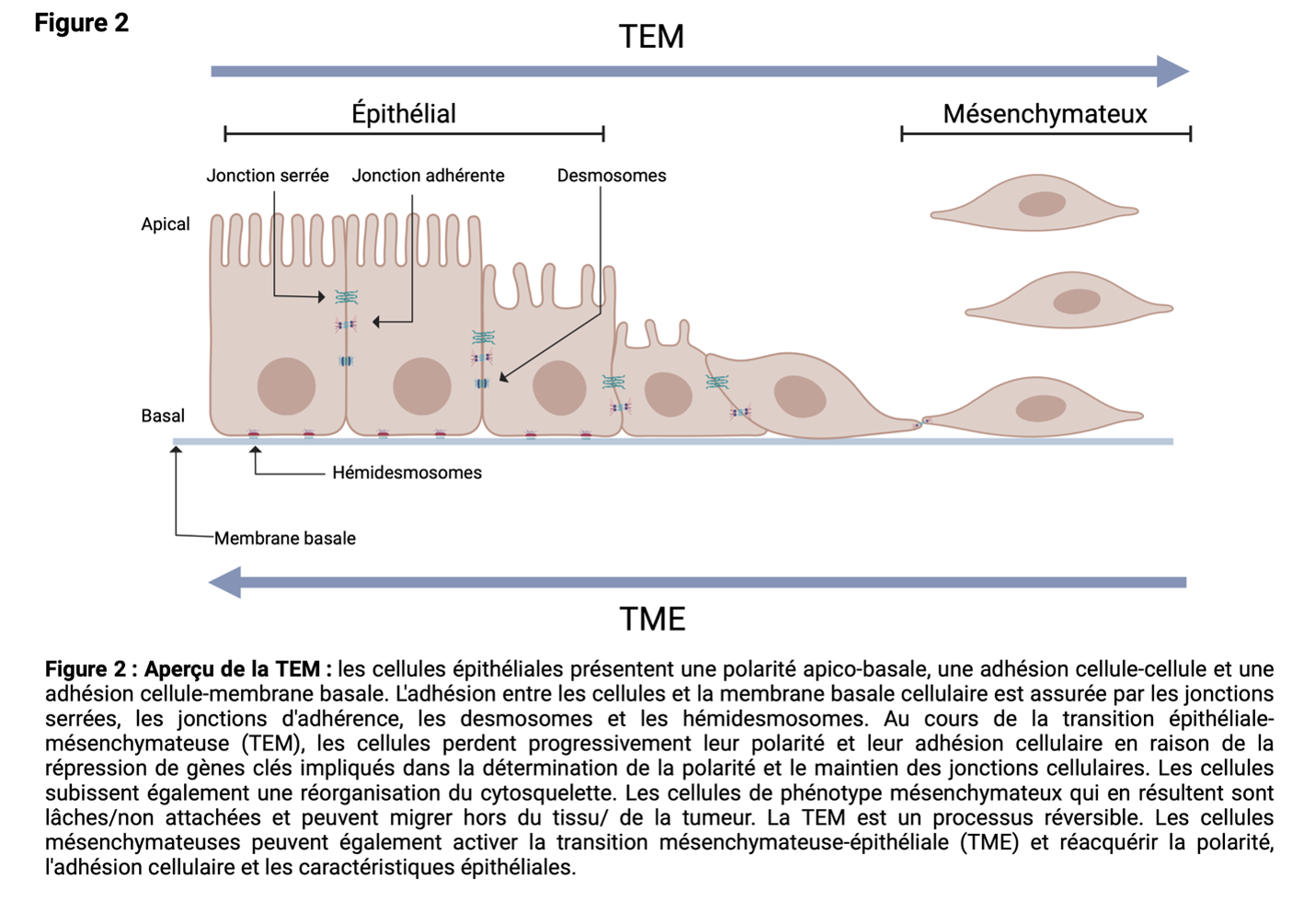
Transition épithéliale-mésenchymateuse (TEM)
La TEM est induite par une série de facteurs, notamment l'hypoxie, les cytokines, les facteurs de croissance, les réponses immunitaires à la tumeur et les traitements anticancéreux. En raison de lla TEM, certaines cellules cancéreuses de la tumeur primaire perdent les adhésions membranaires cellule-cellule ou cellule-base et subissent une réorganisation du cytosquelette. Les cellules passent d'un phénotype épithélial à un phénotype hybride épithélial-mésenchymateux ou mésenchymateux. Ces cellules peuvent alors migrer hors de la tumeur primaire.
Intravasation et extravasation
Les cellules métastatiques migratrices envahissent ensuite le vaisseau lymphatique ou sanguin le plus proche et accèdent à la circulation par un processus appelé intravasation. L'intravasation implique des interactions complexes entre les cellules cancéreuses et les cellules endothéliales vasculaires.
Les cellules malignes dans la circulation sont transportées vers les sites secondaires de métastase. Au niveau du site secondaire, les cellules cancéreuses sortent du vaisseau sanguin/lymphatique en interagissant avec les cellules endothéliales et ce processus est appelé extravasation (Figure 4).
Les cellules qui ont été extravasées subissent une transition mésenchymateuse à épithéliale (TME). Au cours de cette transition, les cellules acquièrent à nouveau un phénotype épithélial. Les adhérences cellulaires sont rétablies et une tumeur secondaire se forme à partir des cellules métastatiques. Ce processus de localisation est très spécifique et dépend également du microenvironnement tissulaire.
TEM et modification des histones
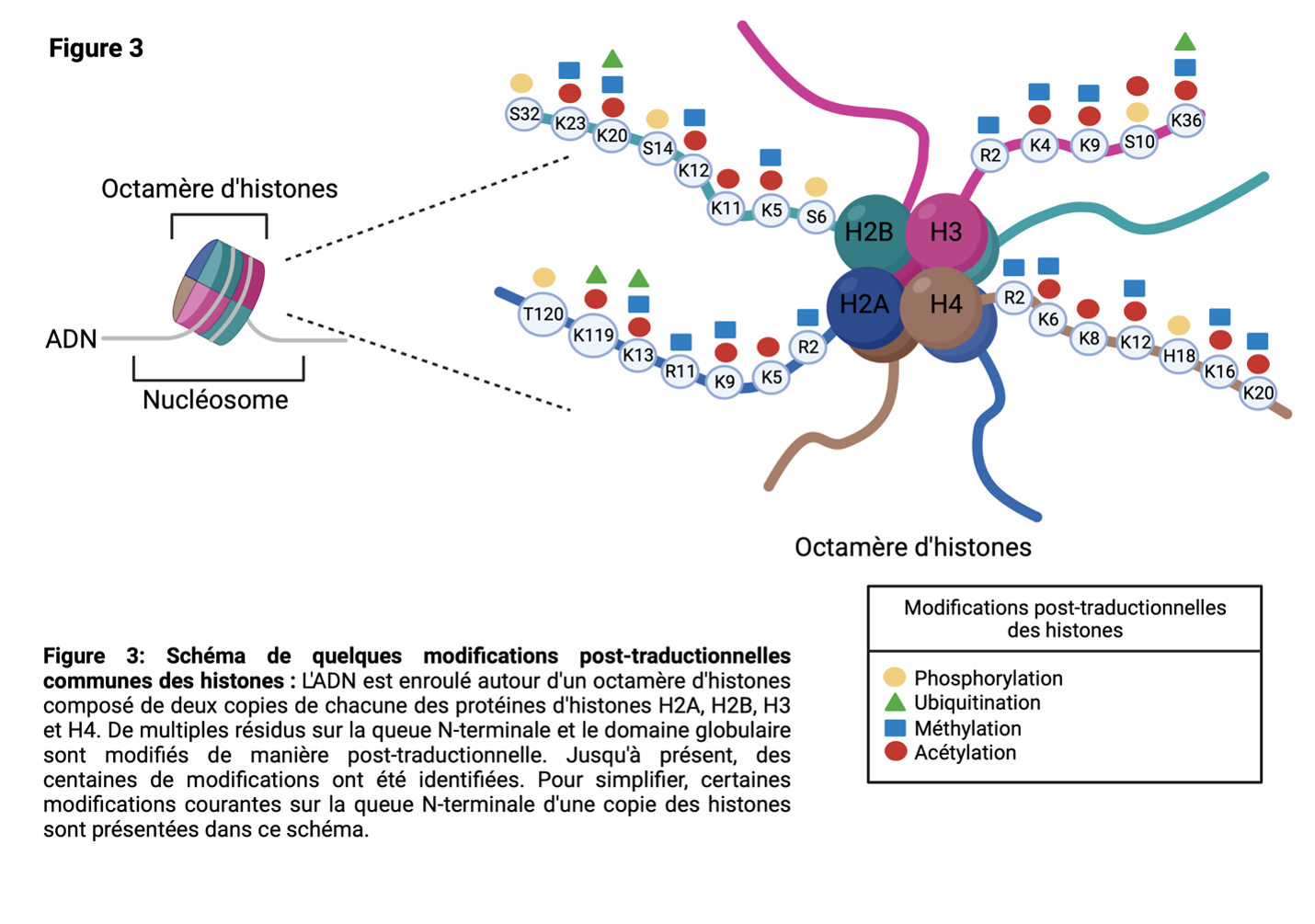
Les histones sont des protéines qui jouent un rôle dans l'emballage de l'ADN dans la chromatine. Dans le noyau des cellules, l'ADN est enroulé autour d'un octamère d'histones composé de 2 copies de chacune des histones H2A, H2B, H3 et H416 (Figure 4). La composition de l'octamère n'est pas figée, et H2A, H2B, H3 et H4 sont parfois remplacées par des variantes d'histones.
Les protéines histones possèdent de multiples résidus, principalement sur la région de la queue N-terminale, qui peuvent être modifiés post-traductionnellement (Figure 3). Il est important de noter que la modification post-traductionnelle de l'histone et du résidu peut avoir des conséquences variées, notamment des changements dans l'accessibilité de l'ADN à la machinerie de transcription18,19. Comme cela peut affecter l'expression des gènes, les enzymes responsables des modifications des histones sont étroitement contrôlées. L'expression aberrante de ces enzymes est liée à de nombreuses maladies, dont le cancer.
Selon leur effet sur l'expression des gènes, il existe deux grandes catégories de modifications des histones : les modifications activatrices et les modifications répressives (Figure 4). Les modifications activatrices des histones comprennent l'acétylation, la déméthylation et, rarement, la méthylation. Les histones acétyltransférases et les histones déméthylases sont responsables de ces modifications.
Les modifications répressives des histones comprennent la méthylation, la désacétylation et, rarement, la déméthylation. Les méthyltransférases et les désacétylases d'histone sont responsables de ces modifications.
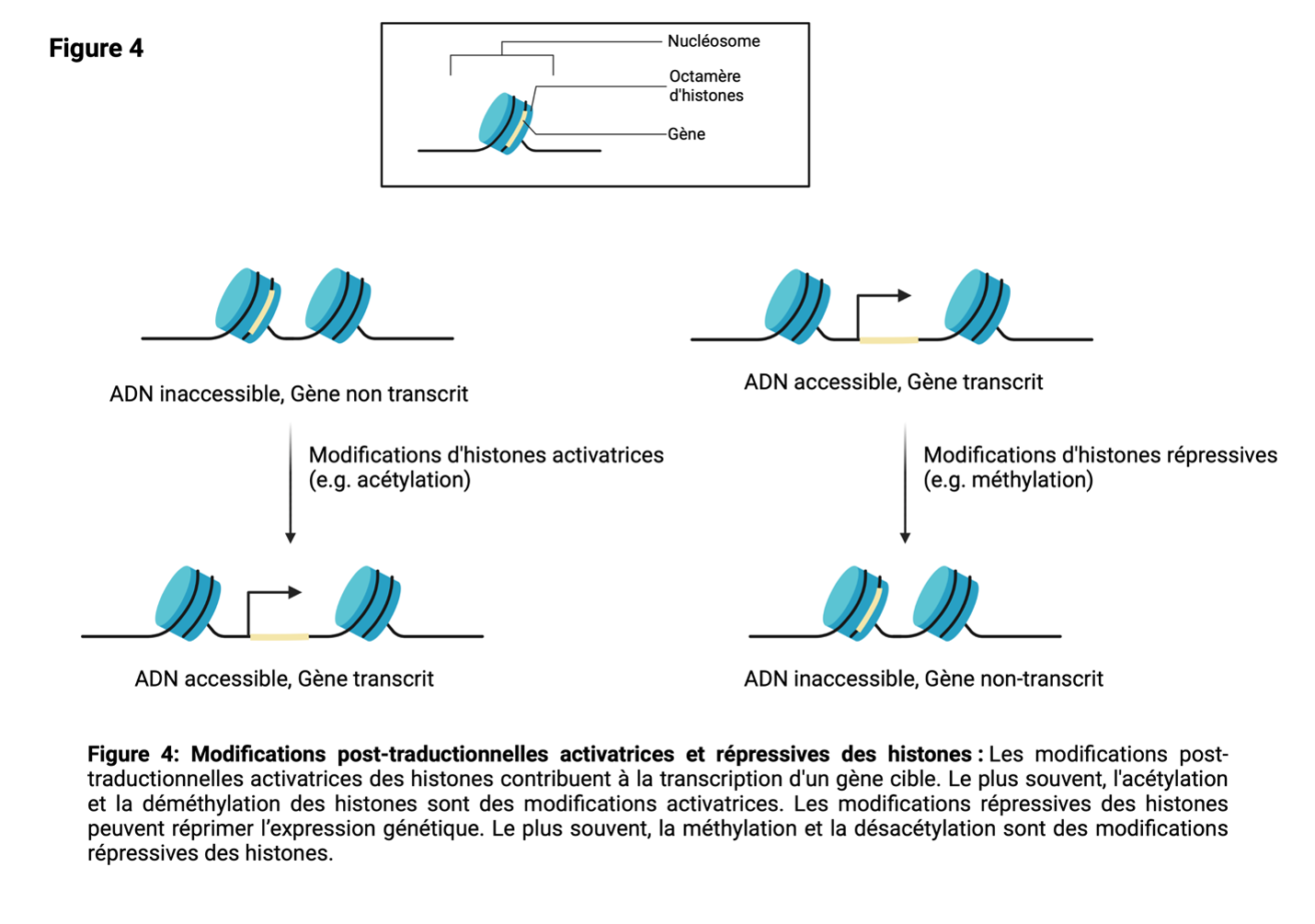
Modifications d'histones activatrices
Wang et al. ont montré que la TEM induite par l'hypoxie conduit à une augmentation significative d’une modification d'histone activatrice - acétylation de la lysine 4 de l'histone 3 au niveau du promoteur des gènes GLI1 et SMO22. La surexpression de GLI1 et SMO entraîne une augmentation significative des capacités de migration et d'invasion des cellules cancéreuses, comme le montre le carcinome épidermoïde de la tête et du cou.
Snail (SNAI1) et Slug (SNAI2) sont deux facteurs de transcription majeurs qui favorisent la TEM dans les contextes du développement et du cancer. Il a été démontré que le facteur de croissance TGF-beta est fortement exprimé dans le cancer du sein métastatique. De plus, la surexpression de Snail/Slug conduirait à l'enrichissement de l'acétylation de la lysine 9 de l'histone 3, une modification activatrice, au niveau du promoteur du récepteur 2 du TGF bêta (TGFBR2), une protéine de la voie du TGF bêta, conduisant à la surexpression du TGFBR223. Il a été démontré que l'histone acétyltransférase hMOF maintient l'expression de gènes nécessaires au phénotype épithélial tels que TMS1, CDH1 et ESR1, via l’acétylation de la lysine 16 de l'histone 4 au niveau du promoteur. Dans certains cancers du sein et médulloblastomes, l'hMOF est régulé à la baisse.
La déméthylation répressive des histones au niveau du promoteur des gènes qui induisent la TEM a également été associée aux métastases cancéreuses. Il a été démontré que l'histone déméthylase JMJD2B supprime la méthylation de la lysine 9 de l'histone 3 du promoteur du gène de la vimentine (VIM), ce qui entraîne son activation. Avec d'autres gènes, la vimentine joue un rôle clé dans la TEM26. L'histone déméthylase PHF8 active les gènes inducteurs de la TEM, soit ITGB2, ITGAM et ITGA9, par déméthylation de la lysine 9 de l'histone 3 au niveau de leurs promoteurs. Le facteur de croissance TGF-beta induit la TEM en activant l'histone déméthylase JMJD3. La JMJD3 activée déméthyle la lysine 27 triméthylée de l’histone 3 du promoteur du gène SNAI1 et conduit à l'expression de Snail qui est un inducteur critique de la TEM28.
Modifications répressives des histones
EZH2 est une histone méthyltransférase qui réprime les gènes par la méthylation de la lysine 27 de l'histone 3 au niveau du promoteur. Dans plusieurs cancers, EZH2 est surexprimé, ce qui entraîne la répression de gènes tels que CDH1, AXIN2, NKD1, PP2R2B qui sont importants pour le maintien du phénotype épithélial ou pour le contrôle des inducteurs de la TEM29. Lorsque ces gènes sont réprimés, les cellules subissent une TEM, et le cancer devient métastatique.
On a découvert que Snail (SNAI1), qui est le principal inducteur de la TEM, recrute l'histone méthyltransférase G9a pour déposer des marques de méthylation répressives sur la lysine 9 de l'histone 3 au niveau du promoteur du gène CDH1, un marqueur épithélial.
SNAI1 recrute également le complexe SIN3A sur le gène marqueur épithélial CDH131. Le complexe SIN3A contient des histones désacétylases. Comme la désacétylation des histones a un effet répressif sur l’expression génétique, SIN3A peut donc réprimer CDH1 et permettre aux cellules de subir une TEM.
Conclusion
Les métastases sont un phénomène bien connu associé à pronostic plus défavorable dans le cancer. Les cellules malignes deviennent métastatiques en exploitant plusieurs processus biologiques, dont la TEM. Dans de nombreux cancers, des aberrations dans les modifications post-traductionnelles des histones entraînent une altération de l'expression des gènes clés de la TEM, ce qui augmente le potentiel métastatique des cellules malignes. La poursuite des recherches sur le processus et les gènes impliqués dans les modifications d'histones qui conduisent au cancer métastatique offre un grand potentiel pour améliorer le diagnostic et les traitements du cancers.
Pour en savoir plus :
- Revue de littérature sur les métastases et les modifications des histones
- L’épigénétique de la progression du cancer
- Résumé de la TEM
Remerciements :
Nous tenons à remercier le Dr Linda Penn et le Dr Mohammadi Gharrari du Princess Margaret Cancer Centre pour avoir fourni l'examen expert de cet article. Merci également à Elizabeth Elder pour la traduction française.
Images créées dans www.BioRender.com
Références :
1. Wittekind C, Neid M. Cancer Invasion and Metastasis. Oncology. 2005;69(Suppl. 1):14-16. doi:10.1159/000086626
2. Definition of carcinoma in situ - NCI Dictionary of Cancer Terms - NCI. Published February 2, 2011.
3. Lambert AW, Pattabiraman DR, Weinberg RA. Emerging Biological Principles of Metastasis. Cell. 2017;168(4):670-691. doi:10.1016/j.cell.2016.11.037
4. Divoli A, Mendonça EA, Evans JA, Rzhetsky A. Conflicting Biomedical Assumptions for Mathematical Modeling: The Case of Cancer Metastasis. PLOS Comput Biol. 2011;7(10):e1002132. doi:10.1371/journal.pcbi.1002132
5. Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization. Nat Rev Cancer. 2009;9(4):274-284. doi:10.1038/nrc2622
6. Gros J, Tabin CJ. Vertebrate Limb bud formation is initiated by localized Epithelial to Mesenchymal Transition. Science. 2014;343(6176):1253-1256. doi:10.1126/science.1248228
7. Correa-Costa M, Andrade-Oliveira V, Braga TT, et al. Activation of platelet-activating factor receptor exacerbates renal inflammation and promotes fibrosis. Lab Invest. 2014;94(4):455-466. doi:10.1038/labinvest.2013.155
8. Banerjee P, Venkatachalam S, Mamidi MK, Bhonde R, Shankar K, Pal R. Vitiligo patient-derived keratinocytes exhibit characteristics of normal wound healing via epithelial to mesenchymal transition. Exp Dermatol. 2015;24(5):391-393. doi:10.1111/exd.12671
9. Grande MT, Sánchez-Laorden B, López-Blau C, et al. Snail1-induced partial epithelial-to-mesenchymal transition drives renal fibrosis in mice and can be targeted to reverse established disease. Nat Med. 2015;21(9):989-997. doi:10.1038/nm.3901
10. Nakaya Y, Sukowati EW, Wu Y, Sheng G. RhoA and microtubule dynamics control cell–basement membrane interaction in EMT during gastrulation. Nat Cell Biol. 2008;10(7):765-775. doi:10.1038/ncb1739
11. Roche J. The Epithelial-to-Mesenchymal Transition in Cancer. Cancers. 2018;10(2):52. doi:10.3390/cancers10020052
12. Jolly MK, Mani SA, Levine H. Hybrid epithelial/mesenchymal phenotype(s): The ‘fittest’ for metastasis? Biochim Biophys Acta BBA - Rev Cancer. 2018;1870(2):151-157. doi:10.1016/j.bbcan.2018.07.001
13. Thiery JP. Epithelial–mesenchymal transitions in tumour progression. Nat Rev Cancer. 2002;2(6):442-454. doi:10.1038/nrc822
14. Chiang SPH, Cabrera RM, Segall JE. Tumor cell intravasation. Am J Physiol - Cell Physiol. 2016;311(1):C1-C14. doi:10.1152/ajpcell.00238.2015
15. Strilic B, Offermanns S. Intravascular Survival and Extravasation of Tumor Cells. Cancer Cell. 2017;32(3):282-293. doi:10.1016/j.ccell.2017.07.001
16. McGhee JD, Felsenfeld G. Nucleosome Structure. Annu Rev Biochem. 1980;49(1):1115-1156. doi:10.1146/annurev.bi.49.070180.005343
17. Henikoff S, Furuyama T, Ahmad K. Histone variants, nucleosome assembly and epigenetic inheritance. Trends Genet. 2004;20(7):320-326. doi:10.1016/j.tig.2004.05.004
18. Jenuwein T, Allis CD. Translating the Histone Code. Science. 2001;293(5532):1074-1080. doi:10.1126/science.1063127
19. Bartee L, Shriner W, Creech C. Eukaryotic epigenetic regulation. Published online 2017.
20. Hake SB, Xiao A, Allis CD. Linking the epigenetic ‘language’ of covalent histone modifications to cancer. Br J Cancer. 2004;90(4):761-769. doi:10.1038/sj.bjc.6601575
21. Markouli M, Strepkos D, Basdra EK, Papavassiliou AG, Piperi C. Prominent Role of Histone Modifications in the Regulation of Tumor Metastasis. Int J Mol Sci. 2021;22(5):2778. doi:10.3390/ijms22052778
22. Wang JQ, Yan FQ, Wang LH, et al. Identification of new hypoxia-regulated epithelial-mesenchymal transition marker genes labeled by H3K4 acetylation. Genes Chromosomes Cancer. 2020;59(2):73-83. doi:10.1002/gcc.22802
23. Dhasarathy A, Phadke D, Mav D, Shah RR, Wade PA. The Transcription Factors Snail and Slug Activate the Transforming Growth Factor-Beta Signaling Pathway in Breast Cancer. PLOS ONE. 2011;6(10):e26514. doi:10.1371/journal.pone.0026514
24. Kapoor-Vazirani P, Kagey JD, Powell DR, Vertino PM. Role of hMOF-dependent histone H4 lysine 16 acetylation in the maintenance of TMS1/ASC gene activity. Cancer Res. 2008;68(16):6810-6821. doi:10.1158/0008-5472.CAN-08-0141
25. Zhao L, Li W, Zang W, et al. JMJD2B promotes epithelial-mesenchymal transition by cooperating with β-catenin and enhances gastric cancer metastasis. Clin Cancer Res Off J Am Assoc Cancer Res. 2013;19(23):6419-6429. doi:10.1158/1078-0432.CCR-13-0254
26. Usman S, Waseem NH, Nguyen TKN, et al. Vimentin Is at the Heart of Epithelial Mesenchymal Transition (EMT) Mediated Metastasis. Cancers. 2021;13(19):4985. doi:10.3390/cancers13194985
27. Björkman M, Östling P, Härmä V, et al. Systematic knockdown of epigenetic enzymes identifies a novel histone demethylase PHF8 overexpressed in prostate cancer with an impact on cell proliferation, migration and invasion. Oncogene. 2012;31(29):3444-3456. doi:10.1038/onc.2011.512
28. Ramadoss S, Chen X, Wang CY. Histone Demethylase KDM6B Promotes Epithelial-Mesenchymal Transition. J Biol Chem. 2012;287(53):44508-44517. doi:10.1074/jbc.M112.424903
29. Ferraro A, Mourtzoukou D, Kosmidou V, et al. EZH2 is regulated by ERK/AKT and targets integrin alpha2 gene to control Epithelial–Mesenchymal Transition and anoikis in colon cancer cells. Int J Biochem Cell Biol. 2013;45(2):243-254. doi:10.1016/j.biocel.2012.10.009
30. Dong C, Wu Y, Wang Y, et al. Interaction with Suv39H1 is critical for Snail-mediated E-cadherin repression in breast cancer. Oncogene. 2013;32(11):1351-1362. doi:10.1038/onc.2012.169
31. Peinado H, Ballestar E, Esteller M, Cano A. Snail mediates E-cadherin repression by the recruitment of the Sin3A/histone deacetylase 1 (HDAC1)/HDAC2 complex. Mol Cell Biol. 2004;24(1):306-319. doi:10.1128/MCB.24.1.306-319.2004